
近日,beat365中文版官方网站beat365中文版官方网站、自然科学研究院洪亮教授课题组和合作者在英国皇家化学学会(Royal Society of Chemistry)的旗舰期刊《Chemical Science》上发表了题为“Non-ergodicity of a globular protein extending beyond its functional timescale”的最新研究成果,报道了蛋白质功能运动随着观测时间增长而逐渐变慢的奇异现象,并解释了其微观机理。
论文链接:
https://doi.org/10.1039/D2SC03069A
蛋白质分子的内部运动,尤其是功能结构域间的相对运动与其完成各种生物功能或者催化作用紧密相关。然而有趣的问题是:一种特定的功能运动是否有特定的时间尺度与其对应呢?在序列,结构和环境完全一样的情况下,同一种蛋白分子的动力学或者功能是否会存在个体差异呢?洪亮课题组通过全原子分子动力学模拟和单分子能量共振荧光显微镜实验,对SHP2络氨酸磷酸酶蛋白单分子的动力学行为进行了统计研究。结果表明,在结构和环境完全一样的情况下,横跨14个时间尺度(从皮秒到分钟:10-12 - 102秒),每个蛋白质分子动力学行为各不相同,有快有慢,有动有静,而且整体随着观测时间变长逐渐减慢(图1A)。然而这些新奇现象却与单链DNA的运动行为形成鲜明对比,后者个体差异基本没有(图1B)。团队借助复杂网络和图论的知识,刻画出蛋白质和DNA分子的自由能势能面,并对比分析,发现蛋白分子的新奇运动是由其自相似、分形的“链-岛”自由能图谱造成的(图2)。本工作的一个重要衍生结果是,一模一样的蛋白质分子,其功能效率和动力学行为个体差异很大,对自然环境的适应能力可以非常不同,出现种群分化“population splitting”。这将有助于生物大分子乃至生命体在恶劣环境下演化,部分种群得以生存。
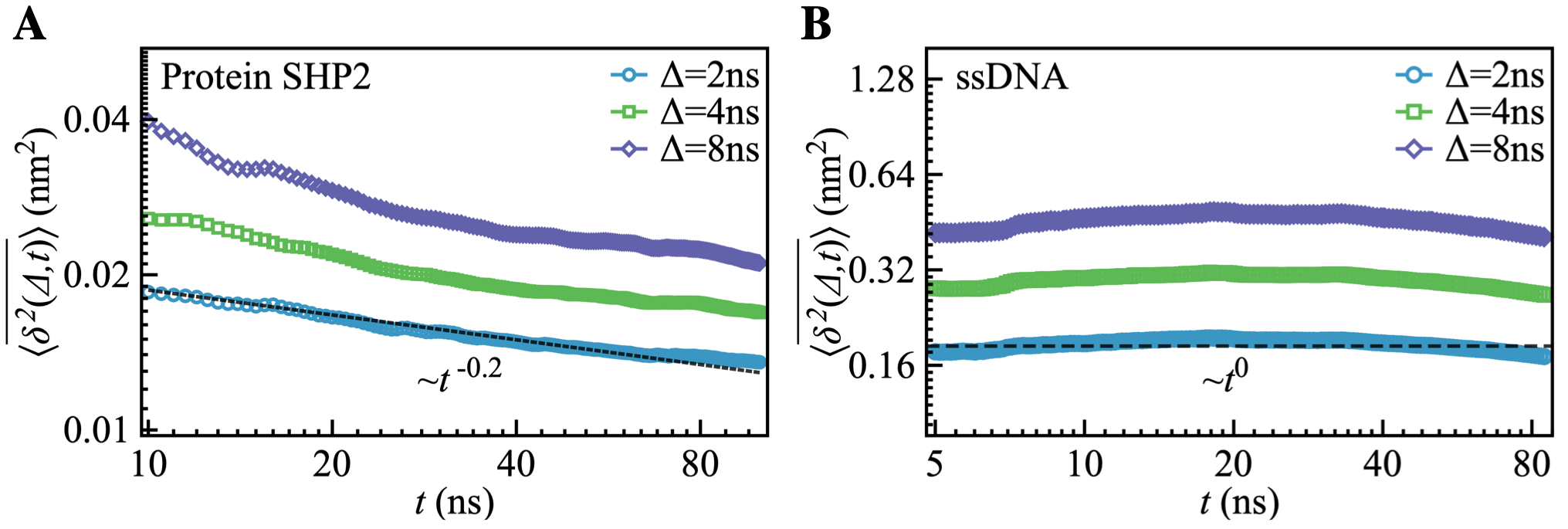
图1: 蛋白质的老化“aging”动力学。(A). 蛋白质分子的运动随着观测时间变长而逐渐减慢。(B). 单链DNA分子并无老化动力学行为。
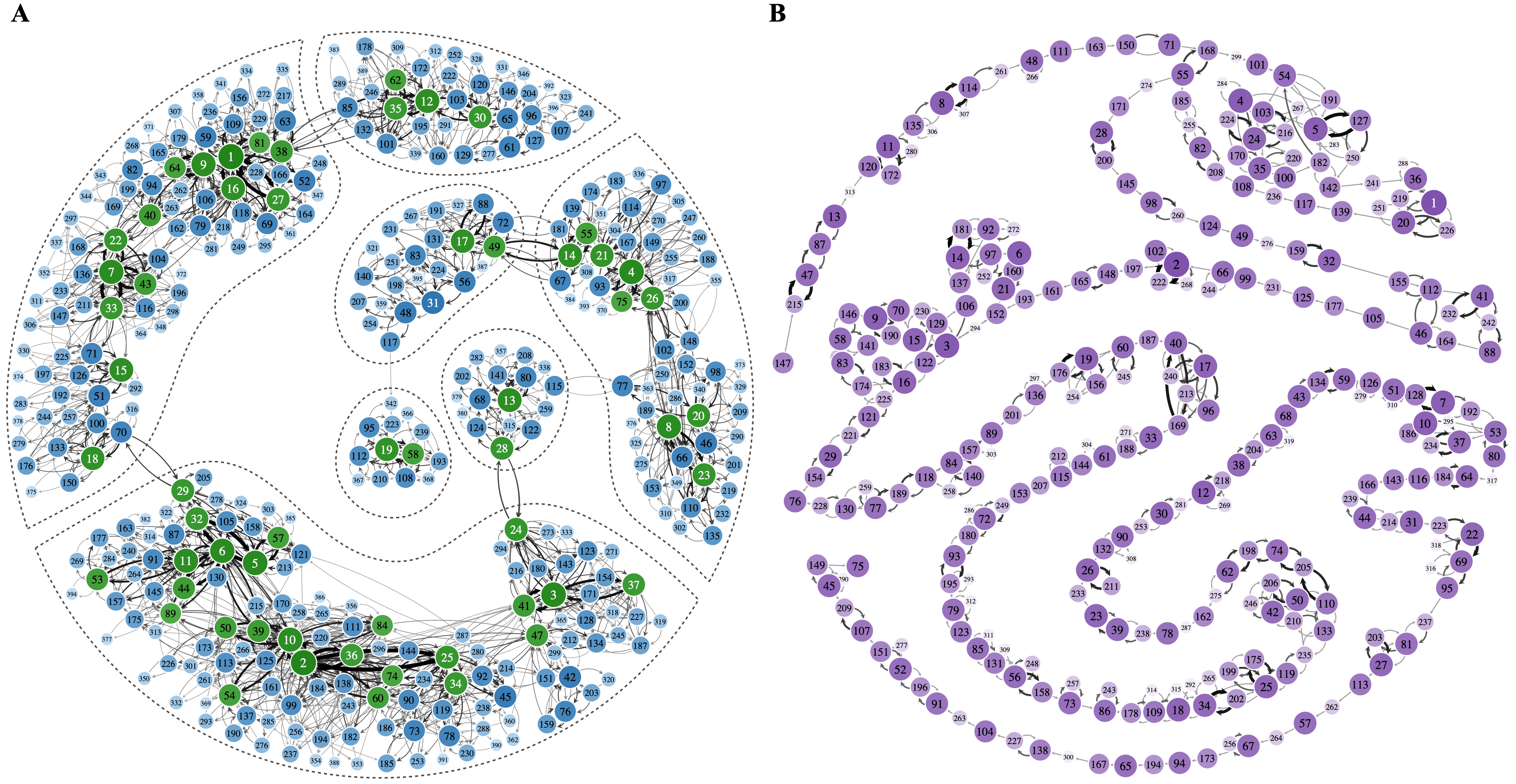
图2: 分子的构象转移网络,边或点的颜色深浅与概率成正比,因此它代表蛋白分子的能量势能面。(A). 蛋白分子“链-岛”状势能面。(B). 单链DNA分子的运动网络。
beat365中文版官方网站beat365中文版官方网站、自然科学研究院洪亮教授为本文唯一通讯作者,beat365中文版官方网站博士生李俊为第一作者。理论模型的改进得到了美国田纳西大学/橡树林国家实验室Prof. Jeremy C. Smith,和德国马克斯·普朗克研究所Dr. Aljaž Godec的帮助。单分子实验设计和数据采集得到了中国科学院上海有机化学研究所刘聪研究员和谢静菲博士的帮助,单分子实验同样也得到了美国北卡罗来州立大学Prof. Keith R. Weninger的帮助。本工作得到了国家自然科学基金委、上海市科委、教委、上海人工智能国家实验室和张江高等研究院的支持,以及beat365中文版官方网站学生创新中心和beat365中文版官方网站高性能计算中心的支持。




