
2017年7月,beat365中文版官方网站beat365中文版官方网站和自然科学研究院洪亮课题组及其美国橡树岭国家实验室的合作者在《Physical Review Letters》(物理评论快报)上发表了在蛋白质动力学转变现象上的新发现。
蛋白质被称为生命发动机,承担了生命体绝大多数的功能。地球上有成百上千万蛋白质,它们的结构大不相同,行使着各式各样的生物功能。然而蛋白质都会在约零下70°C发生动力学转变:低于此温度蛋白质就像块石头,内部运动主要是简谐振动,当提高温度跨越此转变点,蛋白质就会柔化并展现出非简谐运动。有实验表明:当降温到-70°C以下,一些蛋白质不仅丢失其非简谐运动的自由度,同时也丧失了生物活性,例如失去结合催化底物的能力。因此研究蛋白质动力学转变机理,不仅仅是个有意思的物理问题,同时也对理解生命活性如何产生及其同蛋白质动力学的关系非常重要。
在过去三十年,很多实验和理论工作指出,蛋白质的动力学转变是由附着在蛋白质表面的水分子在-70°C发生变化引起的。简而言之,附着水分子在此温度会发生玻璃化转变或相变,丧失长程扩散自由度。由于水分子同包裹其内的蛋白分子有较强的物理作用,比如氢键,水在-70°C的固化将导致蛋白质丢失非简谐运动的自由度,以及和这些运动关联的生物活性。这就解释了为什么不同蛋白的动力学转变都在类似温度,因为尽管蛋白不同,它表面的水分子本质是相同的。
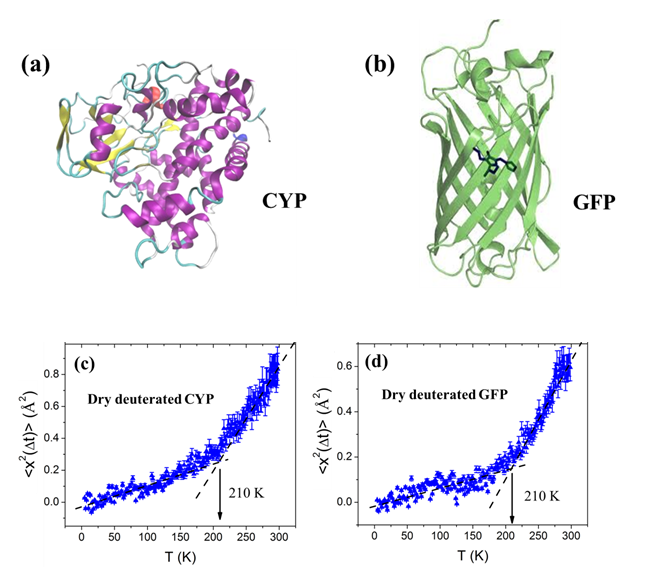
图1: (a) 细胞色素蛋白(CYP) 结构示意图,(b) 绿色荧光蛋白(GFP) 结构示意图;中子散射测试得到的不同温度下冻干蛋白质重原子(C, N, O)在纳秒时间内的均方位移<x2(Δt)>: (c) 全氘化细胞色素蛋白(D-CYP)和 (d) 全氘化绿色荧光蛋白(D-GFP)。
中子散射可以直接测量原子核运动,是研究蛋白质动力学转变现象非常重要的实验手段。 中子对氢原子特别敏感,而蛋白质富含氢原子(尤其是其侧链),造成中子散射测到的主要是蛋白质氢原子尤其是侧链氢的运动信号。洪亮课题组运用全氘化蛋白,巧妙得减弱了氢原子信号的影响,从而测量蛋白质中重原子(C, N, O)尤其是主链重原子的运动。他们发现并证实完全干燥的蛋白也会在-70°C发生动力学转变。其研究表明蛋白质的动力学转变这一现象的存在不依赖于水,是蛋白质固有的性质,但水的加入会大大增强这一转变现象。这一发现对过去三十年在此领域建立的经典图象——蛋白动力学转变是由水引起的,提出了挑战和质疑,势必引起学术界对此课题的新思考和进一步研究。
此项目受到国家自然基金(11504231和31630002)支持,洪亮课题组博士生刘卓是第一作者,洪亮特别研究员是通讯作者,beat365中文版官方网站是该工作的第一单位。




